Um regime antimicrobiano “empírico” é iniciado antes da identificação do micro-organismo agressor e às vezes antes da documentação da presença de infecção, onde o regime “definitivo” é instituído quando o micro-organismo causador é conhecido.
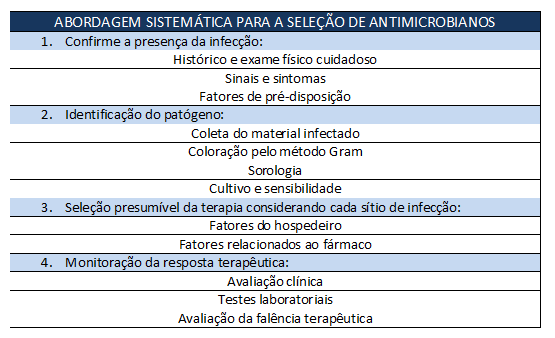
Como confirmar a presença da infecção?
FEBRE:
Febre é definida como elevação controlada da temperatura corporal acima de 37°C (medido oralmente) e é manifestação de outras doenças que não infecção.
Alguns fármacos foram identificados como causadores de febre. Febre induzida por fármaco é definida como febre persistente na ausência de infecção ou outras condições desconhecidas. A febre deve coincidir temporalmente com a administração do agente agressor e desaparecer prontamente após a sua retirada, após isso a temperatura permanece normal.
SINAIS E SINTOMAS:
Contagem de células brancas do sangue:
- A maioria das infecções resulta em contagem elevada das células brancas do sangue (leucocitose) devido à mobilização de granulócitos e/ou linfócitos para destruir os micróbios invasores. Valores normais para as contagens de células brancas do sangue variam entre 4.000-10.000 céls./mm³.
- As infecções bacterianas estão associadas com elevadas contagem de granulócitos (neutrófilos e basófilos), frequentemente com aumento de formas imaturas (neutrófilos em banda) vistos no sangue periférico em esfregaços. Com infecção, a contagem de leucócitos periféricos pode ser alta, mas eles raramente estão maiores do que 10.000-30.000 céls./mm³ (4×109 – 10×109 / L). A baixa contagem de neutrófilos (neutropenia) após o início da infecção indica uma resposta anormal e estão geralmente associadas a um mau prognóstico para a infecção bacteriana.
- A linfocitose relativa, mesmo com a contagem normal ou levemente elevada de células brancas do sangue, é geralmente associada à tuberculose ou infecções fúngicas. Alguns tipos de infecção, entretanto, podem ser acompanhadas por uma contagem completamente normal e diferencial de células brancas do sangue.
DOR E INFLAMAÇÃO:
- Dor e inflamação pode acompanhar a infecção e são algumas vezes manifestadas por edema, eritema, hiperalgesia e secreção purulenta. Infelizmente, esses sinais podem talvez apareçam somente se a infecção for superficial ou em um osso ou articulação.
- As manifestações de inflamação em infecções profundas como meningite, pneumonia, endocardite, infecções do trato urinário devem ser verificadas por exames teciduais ou de fluidos. Por exemplo, a presença de leucócitos polimorfonucleares (neutrófilos) no líquido cefaloraquidiano, secreções pulmonares (escarro) e urina é altamente sugestivo de infecção bacteriana.
Como identificar o patógeno?
Amostras corporais infectadas devem ser analisadas, se possível ou prático, antes da instituição do regime antimicrobiano. A coloração do material pelo método de Gram pode revelar bactérias, ou uma coloração ácido-resistente pode detectar micobactérias ou actinomicetos.
Culturas de sangue podem ser feitas em pacientes gravemente enfermos e pacientes febris. Fluidos ou tecidos menos acessíveis são obtidos quando necessários para avaliar os sinais ou sintomas (por exemplo, líquido cefalorraquidiano na meningite, líquido sinovial na artrite). Abcessos e áreas celulíticas também devem ser aspiradas.
Deve-se ter cuidado na avaliação de resultados positivos de culturas resultantes de sítios normalmente estéreis (por exemplo, sangue, líquido cefalorraquidiano, líquido sinovial). O achado de bactérias normalmente encontradas em grande quantidade na pele (por exemplo, Staphylococcus coagulase-positivo, Difteróides) de um desses sítios pode resultar de uma contaminação da amostra ao invés de uma verdadeira infecção.
Como selecionar o regime antimicrobiano presuntivo?
Uma variedade de fatores deve ser considerada para selecionar a terapia antimicrobiana racional, incluindo a severidade e acuidade da doença, fatores relacionados ao hospedeiro, fatores relacionados aos fármacos utilizados, e a necessidade do uso de múltiplos agentes.
A escolha do(s) fármaco(s) para o tratamento da maioria dos patógenos é compilada de uma variedade de fontes e são entendidos como protocolos ao invés de regras específicas para o uso de antimicrobianos.
Quando os regimes antimicrobianos são selecionados, dados de susceptibilidade local devem ser considerados se possível, ao invés da informação publicada por outras instituições ou compilações nacional.
FATORES RELACIONADOS AO HOSPEDEIRO:
Quando um paciente é avaliado para uma terapia inicial ou empírica é avaliado, os seguintes fatores devem ser avaliados:
- Alergia ou histórico de reações adversas a medicamentos.
- Idade do paciente.
- Gravidez.
- Metabolismo ou variações genéticas.
- Funções hepáticas e renais: pacientes com essas funções diminuídas tendem a acumular certos fármacos, a menos que um ajuste de dose seja efetuado.
- Terapia farmacológica concomitante: qualquer terapia concomitante que o paciente esteja recebendo pode influenciar a seleção da terapia farmacológica, a dose e a monitorização.
- Estados patológicos concomitantes.
Quais são os fatores relacionados ao fármaco?
A integração das propriedades farmacocinéticas e farmacodinâmicas de um agente é importante quando da escolha da terapia antimicrobiana para garantira a eficácia e prevenir a resistência. Antibióticos podem demonstrar efeitos bactericidas concentração-dependente (aminoglicosídeos e quinolonas) ou tempo-dependentes (betalactâmicos).
A importância da penetração no tecido varia com o sítio de infecção. O sistema nervoso central é um sítio onde a importância da penetração do antimicrobiano é relativamente bem definida e a correlação com resultados clínicos estão estabelecidos. Fármacos que não alcançam concentrações significativas no líquido cefalorraquidiano devem ser evitados ou instilados diretamente quando tratando meningite.
A parte os vasos sanguíneos, outros fluidos corporais nas quais os dados da concentração do fármaco são clinicamente relevantes são a urina, o líquido sinovial e líquido peritoneal.
Parâmetros farmacocinéticos como área sob a curva de concentração (AUC, do inglês area under the concentration-time curve) e concentração plasmática máxima pode ser preditivo para o resultado do tratamento quando taxas específicas de AUC ou concentração plasmática máxima para a concentração inibitória mínima (MIC, do inglês minimum inhibitory concentration) são alcançadas. Para alguns agentes, a taxa de concentração plasmática (AUC) para a concentração inibitória mínima (MIC), a taxa de pico de concentração para a concentração inibitória mínima, ou o tempo que a concentração do fármaco está acima da concentração inibitória mínima (MIC) pode predizer a eficácia.
A relação farmacodinâmica mais importante para antimicrobianos que mostram efeitos bactericidas tempo dependente (como as penicilinas e as cefalosporinas) é a duração de tempo que a concentração do fármaco excede a concentração inibitória mínima.
Quando usar um regime antimicrobiano combinado?
A combinação de antimicrobianos é geralmente usada para ampliar o espectro de cobertura da terapia empírica, alcançando atividade sinérgica contra os organismos invasores, prevenindo a emergência de resistência.
O aumento da cobertura da terapia antimicrobiana geralmente é necessária em coinfecções nas quais múltiplos micro-organismos podem estar presentes, tais como infecções intra-abdominais e infecções pélvicas, nas quais uma variedade bactérias aeróbicas e anaeróbicas podem produzir doenças. Outras situações clínicas nas quais o aumento do espectro de atividade são desejadas são as infecções nosocomiais.
Sinergismo:
- O alcance da atividade sinérgica antimicrobiana é uma vantagem para infecções provocadas por bacilos gram-negativos em pacientes imunocomprometidos.
- Tradicionalmente, as combinações de aminoglicosídeos e betalactâmicos são usadas devido esses fármacos associados agirem geralmente sinergicamente contra uma larga variedade de bactérias. Entretanto, os dados que apoiam uma maior eficácia das combinações sinérgicas sobre as não sinérgicas, são fracos.
- Combinações sinérgicas podem produzir melhores resultados em infecções provocadas por Pseudomonas aeruginosa, bem como em certas infecções causadas por Enterococcus spp.
- O uso de combinações para prevenir a emergência de resistência é largamente aplicada, mas não frequentemente realizada. A única circunstância na qual isso é claramente eficaz é no tratamento da tuberculose.
Quais as desvantagens da terapia combinada?
Apesar de existir efeitos benéficos potenciais da combinação de fármacos, também existem desvantagens potenciais, incluindo aumento do custo, maior risco de toxicidade relacionada ao fármaco, e superinfecção com até mesmo mais resistência bacteriana.
Algumas combinações de antimicrobianos são potencialmente antagonistas. Por exemplo, agentes que são capazes de induzir em bactérias a produção de enzimas betalactamases (por exemplo, cefoxitina) podem antagonizar os efeitos de fármacos sensíveis a enzimas como as penicilinas ou imipinem.
Como fazer a monitorização da resposta terapêutica?
Após a instituição do regime antimicrobiano, os pacientes devem ter a resposta terapêutica cuidadosamente monitoradas. Os relatórios de cultura e sensibilidade de espécies coletadas devem ser revisados.
É recomendado o uso de agentes com estreito espectro de atividade contra patógenos identificados.
A monitoração do paciente deve incluir uma variedade de parâmetros, incluindo a contagem de células brancas do sangue, temperatura sinais e sintomas de infecção, apetite, estudos radiológicos quando apropriados, e a determinação da concentração dos antimicrobianos em fluidos do corpo.
À medida que o paciente melhora, a via de administração do antibiótico deve ser reavaliada. O compartilhamento da terapia oral é uma prática aceita para algumas infecções. Critérios que favorecem o compartilhamento da terapia oral incluem:
- Melhora clínica geral.
- Ausência de febre por 8 a 24 horas.
- Diminuição na contagem de células brancas do sangue.
- O trato gastrointestinal deve estar funcional.
O que leva à falência da terapia antimicrobiana?
Uma variedade de fatores podem ser responsáveis pela aparente falta de resposta à terapia. É possível que a doença não seja infecciosa ou não seja bacteriana na sua origem, ou exista um patógeno não identificado. Outros fatores incluem aqueles diretamente relacionados à seleção do fármaco, do paciente ou do patógeno. Erros laboratoriais na identificação do patógeno e/ou erros nos testes d e susceptibilidade são raros.
Quais as falhas provocadas pela seleção do fármaco?
Fatores diretamente relacionados à seleção do fármaco incluem a seleção inapropriada do fármaco, dose, concentração ou via de administração. A má absorção do fármaco devido à doenças gastrointestinas (por exemplo, síndrome do intestino irritado) ou a interação de fármacos (por exemplo, a formação de complexos de quinolonas com cátions multivalente, resultado em uma absorção reduzida) pode levar a uma potencial concentração sérica subterapêutica.
Excreção acelerada do fármaco também é uma razão possível para a falência e pode ocorrer em pacientes com fibrose cística ou durante a gravidez, quando uma depuração mais rápida ou grandes volumes de distribuição podem resultar em baixas concentrações séricas, particularmente para aminoglicosídeos.
Uma causa comum na falha terapêutica é a penetração pobre no sítio de infecção. Isso é especialmente verdade, para os chamados sítios de privilégio imunológico como o sistema nervoso central, olhos e a próstata.
Quais as falhas provocadas por fatores relacionados ao hospedeiro?
Pacientes que são imunocomprometidos (por exemplo, granulocitopenia por quimioterapia e síndrome da imunodeficiência adquirida) pode responder de forma pobre à terapia devido suas defesas serem inadequadas a erradicar a infecção apesar do regime terapêutico aparentemente adequado.
Outros fatores estão relacionados com a necessidade de drenagem cirúrgica de abcessos, ou remoção de corpos estranhos e/ou tecidos necróticos. Se essas situações não forem corretas, elas resultam em infecção persistente e, ocasionalmente, bacteremia, apesar da terapia antimicrobiana adequada.
Quais as falhas provocadas por micro-organismos?
Fatores relacionados à patógenos incluem o desenvolvimento de resistência ao fármaco durante a terapia. Resistência primária refere-se à resistência intrínseca dos patógenos causadores da infecção. Entretanto, a aquisição de resistência durante o tratamento se tornou um grande problema, pois, o aumento da resistência entre organismos patogênicos é creditado em parte, ao uso contínuo excessivo de antimicrobianos na comunidade assim como em hospitais, o aumento da prevalência de pacientes imunocomprometidos que recebem antimicrobianos imunossupressores à longo prazo para prevenção de infecções.
Infecções no sistema nervoso central incluem uma larga variedade de condições clínicas e etiologias: meningite, menigoencefalite, encefalite, abcessos cerebrais e das meninges e infecções secundárias.
Referências bibliográficas
Well, B. G.; DiPiro, J. T.; Schwinghammer, T. L.; DiPiro, C. V. Pharmacotherapy handbook. Ed. Mc Graw Hill Education. 9th edition, 2015 (cap. 35).

Prof. Sanderson Araújo
Editor do blog.
Farmacêutico pela Universidade Federal do Pará.
Mestrado em Neurociência pela Universidade Federal do Pará.
Trabalha em um Instituto de Pesquisa na amazônia há 10 anos.
Vídeoaulas no Youtube: Mente e Saúde – Fisiologia e Farmacologia
Deixe um comentário